Tabla 3: Evaluación de la respuesta a la administración del analgésico AINE ketorolaco, por medio del método de la placa caliente.
Gráfica 1: Potencia y eficacia para tramadol de acuerdo con número de saltos evaluados en modelo de placa caliente
Gráfica 2: Potencia y eficacia para tramadol de acuerdo con número de levantamientos de pata evaluados en modelo de placa caliente
Gráfica 3: Potencia y eficacia para ketorolaco de acuerdo con número de saltos evaluados en modelo de placa caliente
Gráfica 4: Potencia y eficacia para ketorolaco de acuerdo con número de levantamientos de pata evaluados en modelo de placa caliente
DISCUSIÓN
El dolor es una experiencia sensorial y emocional desagradable asociada con una lesión hística real o potencial, o que se describe como ocasionada por dicha lesión. Su fisiopatología es un proceso complejo del sistema nervioso central y periférico. (Schuna A.A, Schmidt M.J., et al; 1999)
Los estados de dolor provocan una estimulación del sistema nervioso simpático que a su vez desencadena la liberación de catecolaminas. Estas dan lugar a un aumento de la contractibilidad y frecuencia cardíaca, taquicardia y vasoconstricción periférica que aumentan la presión arterial y el consumo de oxígeno del miocardio. La centralización de la circulación da lugar a un aumento de la irrigación de los órganos parenquimatosos con lo que también incrementa su absorción y consumo de oxígeno. Por el contrario, periféricamente empeora la oxigenación a causa de la vasoconstricción lo que puede generar acidosis. Si el dolor se mantiene por períodos prolongados pueden producirse estados de shock con bradicardia, hipotensión, CID y aumento de la permeabilidad vascular. Hay una reducción de los movimientos respiratorios y la consiguiente hipoventilación. Este desequilibrio produce una hipoxia generalizada, acidosis respiratoria y metabólica. Como el volumen inspirado es cada vez menor se producen atelectasias pulmonares que predisponen a las neuropatías y en el peor de los casos lleva a un shock neurogénico. (Schuna A.A, Schmidt M.J., et al; 1999)
Los fármacos más utilizados en el tratamiento farmacológico del dolor son principalmente los opioides y los analgésicos antiinflamatorios no esteroideos (AINEs). En este estudio se evaluó la actividad analgésica del tramadol y del ketorolaco en ratas wistar, los cuales pertenecen a los grupos farmacológicos mencionados con anterioridad, respectivamente.
Los receptores del dolor son denominados nociceptores y se encuentran principalmente en piel y otros tejidos. Estos son terminaciones libres que reaccionan frente a estímulos mecánicos, térmicos o químicos. La respuesta ante el estímulo nocivo se da por medio de reflejos de retirada o flexión, que es el resultado de la contracción de un músculo flexor (agonista) y la relajación del músculo extensor (antagonista). Este reflejo de retirada o de flexión es uno de los parámetros más utilizados en el estudio sobre la respuesta ante un estímulo nocivo, denominada también respuesta nociceptiva, que puede ser provocada por un estímulo químico o térmico. En roedores, esta respuesta ha sido utilizada para estudios farmacológicos y de la fisiología de la nocicepción. (Fitzgerald M., 2005)
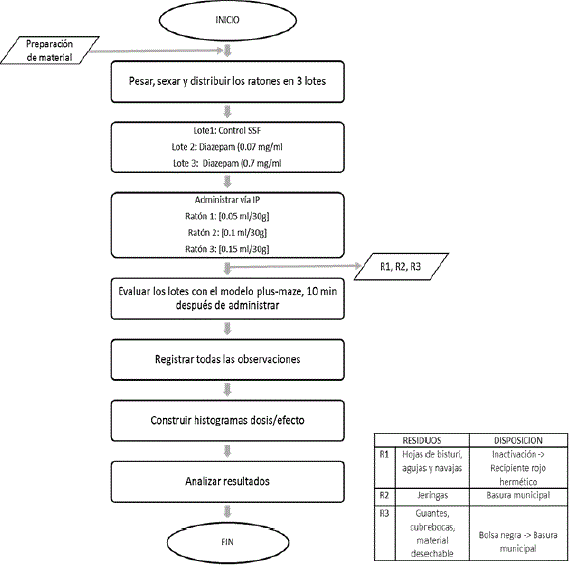
Como método algesiométrico en este trabajo se utilizó el de la placa caliente, el cual es un método que se emplea comúnmente para evaluar la sensibilidad al dolor térmico. La prueba de la placa caliente es un test sencillo y rápido para detectar las propiedades analgésicas de las drogas en cuestión utilizando roedores como modelo biológico. Esta prueba consiste en introducir una rata o ratón en un espacio cilíndrico abierto por arriba y colocandolo encima de una placa caliente. La placa se mantiene a una temperatura constante, que en este caso fue de 50oC +/- 2, y se mide la latencia de reacción del animal que se manifiesta de tres maneras: la lamida de las patas, el levantamiento de las patas y el salto, en donde se considera como salto el levantamiento de ambas patas de la placa al mismo tiempo. Dichas respuestas se consideran como respuestas integradas supraespinales. El tiempo en el que se mantuvo a cada una de las ratas en la placa caliente para este trabajo fue de 15 segundos, después se esperaba un minuto y se volvía a hacer la prueba por duplicado con el mismo animal, reportandose tanto en la tabla 2 como en la tabla 3 de cada analgésico correspondiente, el promedio de los resultados obtenidos para cada parámetro evaluado.
Es necesario mencionar que una particularidad de esta prueba es que se consideran los resultados obtenidos en la primera vez que se somete al animal a la prueba, debido a que son más confiables dado que, cuando se ha hecho un experimento con el animal, este ha aprendido las condiciones a las que fue sometido y a partir de este momento, una vez que se pone el animal encima de la placa caliente, salta muy rápidamente sin expresar las conductas iniciales.
El primer fármaco empleado fue el tramadol, el cual es un potente analgésico considerado dentro del grupo de los agonistas opiáceos que pertenece a la familia de las fenilciclohexanol-aminas. Su efecto analgésico es principalmente de acción central y ha sido usado para el tratamiento de dolor de moderado a severo, de origen agudo o crónico. También puede utilizarse como analgésico preoperatorio, como complemento de anestesia quirúrgica, en el postoperatorio y procedimientos de exploración diagnóstica que cursen con dolor. (Flórez J.,2000). Tiene dos mecanismos de acción complementarios. El enantiómero (+) tiene moderada afinidad por los receptores μ opioides y también inhibe la recaptura de serotonina, mientras que el enantiómero (-) es un potente inhibidor de norepinefrina. (Prakash S., Tyagi R.,et al, 2006). De este modo, existe paralelismo con los antidepresivos que, se cree, potencializan el efecto de aminas en los sistemas de alivio del dolor endógeno. Hay evidencia de que en el tramadol ambos mecanismos actúan sinérgicamente con respecto a la analgesia.
El medicamento en cuestión logra la modulación medular del dolor a través de activación indirecta de los adrenoreceptores alfa-2 postsinápticos, lo cual impide que los impulsos lleguen al cerebro. Así pues, el efecto global del tramadol es resultado de múltiples mecanismos de acción farmacológica opioides y no opioides, de modo que el grado de alivio del dolor es mayor que la suma de los componentes individuales de su acción. Esta sinergia deriva en una reducción significativa de la gama de efectos colaterales típicamente asociados con los opioides, lo que mejora el perfil de seguridad del mismol. (Prakash S., Tyagi R.,et al., 2006). Es útil en dolores de tipo tumoral, en el infarto del miocardio, dolores postquirúrgicos, postraumáticos, del parto y procedimientos diagnósticos invasivos.
Respecto a los resultados obtenidos para tramadol (tabla 2) encontramos qué para el parámetro de número de saltos, la rata control tuvo un promedio de 8 saltos, esta rata se tomó como referencia para analizar los resultados obtenidos en los lotes experimentales adicionales. De acuerdo con los resultados mostrados se pudo observar una disminución de esta respuesta a medida que la dosis del fármaco fue en aumento para cada una de las ratas; encontrando que para la dosis más alta (131.58 mg/kg) el número de saltos fue de 2, lo cual es totalmente congruente, pues el salto del animal refleja la intensidad del dolor térmico que está experimentando y debido a que esta fue la mayor dosis de trabajo para el tramadol puede decirse que la intensidad del dolor disminuye. De manera similar, en el caso del levantamiento de patas para el lote control fueron reportados un total de 23 levantamientos siendo observada mayoritariamente la disminución de la respuesta ante el estimulo térmico de manera directamente proporcional al aumento de la dosis administrada del fármaco opiode con excepción de la dosis mínima administrada (22.62mg/kg). Ahora bien, como puede ser observado para el siguiente parámetro evaluado, es decir, el número de veces que el animal lamió sus patas, pudimos percatarnos de una clara incongruencia en los resultados experimentales, pues se esperaba que la rata control evidenciara la mayor respuesta ante el estímulo térmico ya que al no estar bajo el efecto de un analgésico este animal tuvo que haber experimentado el mayor dolor, sin embargo no sucedió de esta manera siendo que para la determinación de este parámetro las ratas control no evidenciaron dicho comportamiento mientras que las ratas tratadas si lo experimentaron, lo cual nos llevó a discriminar los resultados obtenidos rechazandolos como un parámetro confiable para estimar el efecto analgésico del tramadol. Dichas incongruencias en los resultados fueron atribuidas a que la prueba de placa caliente es un test que depende mucho de la perspectiva de los investigadores que están llevando a cabo la prueba y a su capacidad de contabilizar todos los parámetros evaluados a la vez, de manera adicional se podría atribuir a una incorrecta administración del fármaco en los modelos biológicos de estudio siendo es importante también considerar que el propio metabolismo de cada animal es diferente.
No puede mencionarse que el fármaco todavía no empezaba a ejercer su efecto (analgesia) sobre los animales puesto que el tramadol tiene una biodisponibilidad absoluta del 41-84 % lo que es favorable con relación a otros analgésicos de acción central así como un tiempo de vida biológica media de 6h. presentando el comienzo de acción tras 5 a 10 minutos después de la aplicación intravenosa y después de su administración oral siendo que la realización de la prueba de la placa caliente fue de una hora después de haber administrado el tramadol en las ratas Wistar. Adicionalmente debe mencionarse que el fármaco es ampliamente metabolizado en el hígado (85 % de una dosis oral es metabolizada por esta vía) y aproximadamente el 90 % es excretada por los riñones mientras que un 10 % aparece en las heces fecales. (Bamigbade TA, Langford RM., 2000).
En segundo lugar, se administró ketorolaco a un segundo lote experimental. El ketorolaco se describe como un fármaco antiinflamatorio no esteroideo que posee propiedades analgésicas y antipiréticas encontrándose indicado como analgésico para el alivio a corto plazo del dolor. Cuando se administra sistémicamente su eficacia analgésica y el comienzo del efecto son similares a los de la morfina, pero acompañados de menos efectos secundarios, en particular somnolencia, náuseas y vómitos. Los efectos antiinflamatorios de ketorolaco son consecuencia de la inhibición periférica de la síntesis de prostaglandinas mediante el bloqueo de la enzima ciclooxigenasa. Las prostaglandinas sensibilizan los receptores del dolor, y su inhibición se cree que es responsable de los efectos analgésicos del ketorolaco. La mayoría de los AINEs no modifican el umbral del dolor ni afectan a las prostaglandinas existentes, por lo que el efecto analgésico es más probablemente periférico. La antipiresis puede ocurrir a través de la dilatación periférica causada por una acción central sobre el hipotálamo. Esto se traduce en un flujo creciente de la sangre cutánea y pérdida subsiguiente de calor. Otros efectos debidos a la inhibición de las prostaglandinas son la disminución de la citoprotección de la mucosa gástrica, las alteraciones de la función renal, y la inhibición de la agregación plaquetaria. El ketorolaco presenta una débil actividad como bloqueante anticolinérgico y alfa-adrenérgico. (Flower, RJ, et al. 2005)
Los resultados obtenidos por el método de la placa caliente mostrados en la tabla 3, dan a conocer que en las dosis más altas administradas de dicho fármaco (60 mg/kg y 90 mg/kg), el número de saltos fue nulo indicando que el efecto analgésico se presentaba por completo al grado de inhibir el dolor debido al bloqueo de la generación del impulso doloroso como resultado de la reducción de la actividad de las prostaglandinas y posiblemente mediante inhibición de la síntesis y/o acciones sobre otros mediadores locales de la respuesta inflamatoria, todo esto a nivel periférico.
Respecto al número de levantamiento de patas se observa una relación inversamente proporcional entre este parámetro y la dosis de ketorolaco, es decir, que a una menor concentración del fármaco, el modelo biológico respondía levantando las patas un mayor número de veces, exceptuando la dosis máxima administrada (90 mg/kg) en donde contrario a lo que se esperaba y rompiendo el comportamiento antes descrito, el animal de experimentación presentó 20 levantamientos de patas. Esto da lugar a que la dosis de ketorolaco ideal para ejercer el efecto antiinflamatorio y analgésico se debe de estimar y no necesariamente ejerce el mejor efecto analgésico a mayores concentraciones debido a que la capacidad analgésica no aumenta una vez sobrepasada cierta dosis, lo que se denomina “efecto techo”. (Aliaga, L. et al, 2009)
En cuanto al número de veces que la rata lame las extremidades posteriores, este parámetro fue creciendo de manera directamente proporcional al aumento de la dosis. Si bien la respuesta al estímulo del dolor inducido por el calor provoca que el animal tenga esta respuesta, y tomando en cuenta que el fármaco contribuye a la disminución en la sensación de dolor, este comportamiento puede ser explicado debido a que el ketorolaco actúa eficazmente a una determinada dosis y no precisamente incrementa su efecto al aumentar la concentración, como ya se mencionó anteriormente. Una particularidad de la prueba en placa caliente es que solo se puede aplicar una vez en cada animal, solo en el caso en el que se ha evaluado la respuesta del salto. Efectivamente, cuando se ha hecho un experimento con el animal, este ha aprendido que al ser colocado en la placa sentirá dolor y una vez que se pone el animal encima de la placa caliente, salta inmediatamente al estar en contacto con la misma, sin expresar las conductas de lamer las extremidades inferiores como lo hacía inicialmente. (Le Bars D et al. 2001) Es debido a que en la experimentación se sometieron a los animales a la prueba de la placa caliente dos veces que esta acción pudo modificar el comportamiento del modelo biológico hacia la respuesta de dolor producida por calor y la analgesia provocada por el fármaco. Cabe mencionar que los antiinflamatorios no esteroideos producen alivio del dolor leve-moderado, sobre todo el asociado a la inflamación, son analgésicos de menor potencia que los opiáceos, pero no tienen los efectos indeseables de éstos sobre el SNC.
Ahora bien, tomando en consideración los resultados previamente analizados y siguiendo la finalidad principal de dicho estudio, podemos hacer mención de dos términos primordiales siendo estos la potencia y la eficacia. En primer lugar, se describe como potencia de un fármaco a la concentración del mismo requerida para obtener un efecto determinado mientras que se entiende por eficacia a la intensidad de la respuesta causada por un fármaco, lo que a su vez puede ser descrito como su actividad intrínseca. Como ha sido mencionado con anterioridad un analgésico es aquel fármaco que actúa en las vías de conducción del dolor del SNC dando lugar a la producción de efectos como la analgesia, el alivio y/o desaparición el dolor. Es por esto que un analgésico potente y eficaz será aquel que pueda dar origen a los efectos antes mencionados tras la administración de una mínima cantidad de fármaco siendo que dicha propiedad no sea un factor limitante en la producción y origen del 100% de su efecto ideal, en este caso analgésico, sobre el individuo. De acuerdo con los datos obtenidos tras la sesión experimental podemos entonces decir que dentro del lote experimental administrado con el fármaco tramadol logró observarse una mayor eficacia y potencia del mismo con una dosis de 40.98 mg/kg esto con respecto al comportamiento de los parámetros analizados en el lote control siendo posible mencionar que la potencia del fármaco resulta indicada debido a que se encuentra muy por debajo de la dosis máxima reportada en la literatura para dicho fármaco (400 mg/kg). Por otra parte, en el caso del lote administrado con el analgésico ketorolaco, pudo hacerse evidente una mayor eficacia del mismo en una dosis de 60 mg/kg sin embargo, puede también mencionarse que en este caso la potencia del mismo no resulta la más indicada puesto que la dosis empleada se encuentra muy cercana a la dosis máxima reportada en la literatura (90 mg/kg) para este fármaco. Es debido a que ambos fármacos presentan diferentes clasificaciones y mecanismos de acción que no resulta factible el indicar cuál de los dos posee una mayor eficacia y/o potencia, uno con respecto al otro. Lo que sí resulta posible indicar es que de acuerdo con la literatura, la combinación de ambos fármacos tiene como objetivo el optimizar los regímenes de dosis con el fin de obtener mayores efectos analgésicos y a su vez disminuir la cantidad de efectos adversos originados con su administración. Se sabe que la administración combinada de fármacos opioides con AINES puede dar lugar al uso de menores dosis de los primeros fármacos mencionados con una elevada cantidad de efectos terapéuticos.
El mecanismo por el cual los AINES y opioides interactúan para producir sinergia antinociceptiva es
desconocido, sin embargo de acuerdo con los resultados obtenidos por López, et.al., se sabe que existe un sinergismo positivo entre ambos fármacos siendo que la actividad antinociceptiva de cada uno tiende a ser menor a aquella observada cuando son administrados de manera conjunta, siendo que la potenciación de los efectos antinociceptivos fue demostrada cuando se emplearon dosis bajas de tramadol ya sea con dosis bajas o elevadas de ketorolaco, lo cual es un indicador de que la interacción sinérgica de ambos fármacos es dependiente de la dosis. A partir de las evidencias anteriores se han desarrollado y registrado en México varias formulaciones de la combinación a dosis fija de ketorolaco-tramadol. (Zackova M, et al, 2002)
Al realizar este estudio se observó que el tramadol y el ketorolaco produjeron una analgesia comparable en cuanto a efectividad. Sin embargo, estudios indican que algunos efectos adversos del tramadol son más significativos que los del ketorolaco. Debido a que es un analgésico que actúa centralmente con un mecanismo de acción triple. Por último, resulta importante mencionar que las reacciones adversas que pueden presentarse por el uso de la asociación de estos fármacos se deben a su administración en dosis altas y por un tiempo prolongado. (Zackova M, et al, 2002)
CONCLUSIONES
En este proyecto experimental se realizó un estudio comparativo sobre la actividad analgésica de un fármaco antiinflamatorio no esteroideo (ketorolaco) y un opioide (tramadol) en ratas wistar por medio del modelo farmacológico de la placa caliente con el cual se determinó que el tramadol tuvo mejor potencia y eficacia con una dosis de 40.98 mg/Kg a comparación del fármaco antiinflamatorio no esteroideo ketorolaco, el cual mostró una mayor eficacia a una dosis de 60 mg/kg, dosis cercana a la dosis máxima reportada en la literatura (90 mg/kg). Estos resultados sugieren que el mecanismo de acción del fármaco es un parámetro que influye en el efecto analgésico de ambos fármacos en el modelo experimental, aunado a esto, con base en los datos reportados de manera literaria puede complementarse que existe evidencia de un sinergismo positivo entre el ketorolaco y el tramadol siendo que la administración combinada de fármacos opioides con AINES puede dar lugar al uso de menores dosis de los opioides con una elevada cantidad de efectos terapéuticos.
REFERENCIAS
Aliaga L, Baños J, de Baturell C, Molet J, Rodriguez de la Serna A. (2005) “AINE en el dolor postoperatorio. Dolor postoperatorio, cap. 2”. Curso interactivo del dolor. Sanofi-Winthrop,
Bamigbade TA, Langford RM. (2000). The clinical use of tramadol hidrochloride. Pain Reviews; 5(3): 155-82.
Le Bars D et al. (2001) “Animal Models of Nociception”. Pharmacological Reviews. 53(4):597-652.
Fitzgerald M. The development of nociceptive circuits. Nat Rev Neurosci 2005; 6: 507–20.
Flórez J. (2000). Farmacología Humana. 3ra Ed. Masson. Barcelona, p. 435-452
Flower RJ, Moncada S, Vane JR. (2009) “Agentes analgésico antipiréticos y antiinflamatorios; drogas empleadas en el tratamiento de la gota: Goodman Gilman A, Goodman LS, Rall TW, Murad S: Las bases farmacológicas de la terapéutica” 7ªed, cap. 29. Panamericana.
López, F. [et.al.] (2004) Analysis of the analgesic interactions between ketorolac and tramadol during arthritic nociception in rat. European Journal of Pharmacology 484. 157–165
Prakash S., Tyagi R., Gogia A.R., Singh R., Prakash S. 2006. Efficacy of three doses of tramadol with bupivacaine for caudal analgesia in pediatric inguinal herniotomy. British Journal of Anaesthesia, 97(3):385-388.
Schuna A.A., Schmidt M.J., Walbrandt Pigarelli D. 1999. Rheumatoid arthritis and the seronegative spondyloarthropathies. En DiPiro J.T., Talbert R.L., Yee G.C., Matzke G.R., Wells B.G., Posey L.M. (eds). Pharmacotherapy: A Pathophysiologic Approach. 3a Ed. Appleton & Lange, Stamford CT, p. 1259-1278.
Zackova M, Taddei S, Caló, P. (2002). “Ketorolaco vs. Tramadol en el Tratamiento del Dolor Posoperatorio durante la Cirugía Máxilofacial” Sociedad Iberoamericana de Información Científica